
Осуществите реакции, характеризующие химические свойства:
раствора серной кислоты.
Запишите уравнения проделанных вами реакций в молекулярной и ионной формах. Реакцию с металлом рассмотрите как окислительно−восстановительную.

Взаимодействие с металлами, стоящими в электрохимическом ряду до водорода с образованием соли и выделением газообразного водорода.
$2Al + 3H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + 3H_{2}↑ $
$2Al + 6H^{+} + 3SO_{4}^{2-} = 2Al^{3+} + 3SO_{4}^{2-} + 3H_{2}↑ $
$2Al + 6H^{+} = 2Al^{3+} + 3H_{2}↑$
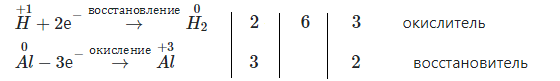
Взаимодействие с основными оксидами с образованием растворимой соли и воды.
$CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O $
$CuO + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + H_{2}O $
$CuO + 2H^{+} = Cu^{2+} + H_{2}O $
Взаимодействие с основаниями с образованием растворимой соли и воды.
$Cu(OH)_{2} + H_{2}SO_{4} = CuSO_{4} + 2H_{2}O $
$Cu(OH)_{2} + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O $
Взаимодействие с солями, если выпадает осадок или выделяется газ.
$BaCl_{2} + H_{2}SO_{4} = 2HCl + BaSO4↓$
$Ba^{2+} + 2Cl^{-} + 2H^{+} + SO_{4}^{2-} = 2H^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓ $
Сильные кислоты вытесняют более слабые из их солей.
$2NaNO_{2} + H_{2}SO_{4} = Na_{2}SO_{4} + 2HNO_{2} $
$2Na^{+} + 2NO_{2}^{-} + 2H^{+} + SO_{4}^{2-}=2Na^{+} + SO_{4}^{2-} + 2HNO_{2} $
$H^{+} + NO_{2}^{-} = HNO_{2}$
Пожалуйста, оцените решение