
1) В две пробирки налейте по 20 капель дистиллированной воды и добавьте по 3—4 капли раствора фиолетового лакмуса. В третью пробирку внесите примерно 20 капель раствора известковой воды. Установите пробирки в штатив. Туда же поместите и три пустые пробирки.
2) В прибор для получения газов внесите 2—3 небольших кусочка мрамора и закрепите прибор в лапке штатива. В воронку налейте немного соляной кислоты, чтобы она покрывала кусочки мрамора. Газоотводную трубку прибора опустите в пробирку с водой, подкрашенной раствором лакмуса. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
3) Пропускайте выделяющийся оксид углерода (IV) через воду до тех пор, пока раствор лакмуса не приобретёт красную окраску. Объясните наблюдаемое и запишите уравнения реакции в молекулярной и ионной формах.
Сравните окраску раствора с окраской раствора в контрольной пробирке.
4) Промойте конец газоотводной трубки в стакане с водой. После этого конец газоотводной трубки перенесите в пробирку с известковой водой и пропускайте газ до помутнения раствора (рис. 49).
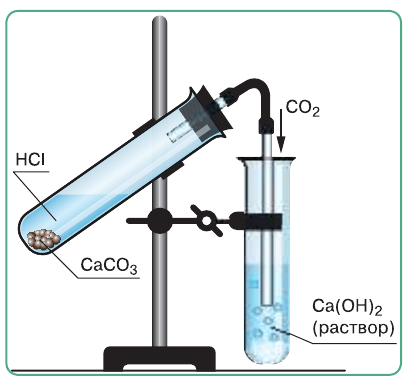
Рис. 49. Прибор для получения углекислого газа
5) Продолжайте пропускать газ через помутневший раствор. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
Примечание. Если скорость выделения газа замедлилась, то в пробирку с мрамором можно добавить немного соляной кислоты.
6) Промойте конец газоотводной трубки в стакане с водой. Перенесите газоотводную трубку в четвёртую пробирку, опустив её до дна пробирки. Соберите газ методом вытеснения воздуха (почему именно этим методом?).
7) Зажгите лучинку и внесите её в пробирку. Что наблюдаете? Объясните наблюдаемое.
8) В одну чистую пробирку налейте 2 мл раствора карбоната натрия, в другую — 2 мл раствора карбоната калия. Добавьте в каждую пробирку 1—2 мл раствора серной кислоты. Что наблюдаете? Запишите уравнения реакций в молекулярной и ионной формах. Разберите установку и приведите в порядок рабочее место. Оформите отчёт.

1) В две пробирки налили по 20 капель дистиллированной воды и добавили по 3—4 капли раствора фиолетового лакмуса. В третью пробирку внесли примерно 20 капель раствора известковой воды. Установили пробирки в штатив. Туда же поместили и три пустые пробирки.
2) В прибор для получения газов внесли 2—3 небольших кусочка мрамора и закрепили прибор в лапке штатива. В воронку налили немного соляной кислоты, чтобы она покрывала кусочки мрамора. Газоотводную трубку прибора опустили в пробирку с водой, подкрашенной раствором лакмуса.
$CaCO_{3} + 2HCl = CaCl_{2} + CO_{2} + H_{2}O$
$CaCO_{3} + 2H^{+} + 2Cl^{-} = Ca^{2+} + 2Cl^{-} + CO_{2} + H_{2}O$
$CaCO_{3} + 2H^{+} = Ca^{2+} + CO_{2} + H_{2}O$
Наблюдаем выделение бесцветного газа − углекислого газа.
3) Пропускали выделяющийся оксид углерода (IV) через воду до тех пор, пока раствор лакмуса не приобрел красную окраску.
$CO_{2} + H_{2}O = H_{2}CO_{3} = H^{+} + HCO_{3}^{-} = 2H^{+} + CO_{3}^{2-}$
Наблюдаем образование раствора красного цвета.
4) Промыли конец газоотводной трубки в стакане с водой. После этого конец газоотводной трубки перенесли в пробирку с известковой водой и пропускали газ до помутнения раствора.
5) Продолжали пропускать газ через помутневший раствор.
$CO_{2} + CaCO_{3} + H_{2}O = Ca(HCO_{3})_{2}$
$CO_{2} + CaCO_{3} + H_{2}O = Ca^{2+} + 2HCO_{3}^{-}$
Примечание. Если скорость выделения газа замедлилась, то в пробирку с мрамором добавляли немного соляной кислоты.
6) Промыли конец газоотводной трубки в стакане с водой. Перенесли газоотводную трубку в четвёртую пробирку, опустив её до дна пробирки. Собрали газ методом вытеснения воздуха.
Так как углекислый газ тяжелее воздуха, то его собирают методом вытеснения воздуха.
7) Зажгли лучинку и внесли её в пробирку.
Лучинка гаснет, так как углекислый газ не поддерживает горение.
8) В одну чистую пробирку налили 2 мл раствора карбоната натрия, в другую — 2 мл раствора карбоната калия. Добавили в каждую пробирку 1—2 мл раствора серной кислоты.
При добавлении серной кислоты к карбонатам наблюдаем выделение пузырьков газа − углекислый газ.
$Na_{2}CO_{3} + H_{2}SO_{4} = Na_{2}SO_{4} + CO_{2} + H_{2}O$
$2Na^{+} + CO^{2-}_{3} + 2H^{+} + SO^{2-}_{4} = 2Na^{+} + SO^{2-}_{4} + CO_{2} + H_{2}O$
$CO^{2-}_{3} + 2H^{+} = CO_{2} + H_{2}O$
$K_{2}CO_{3} + H_{2}SO_{4} = K_{2}SO_{4} + CO_{2} + H_{2}O$
$2K^{+} + CO^{2-}_{3} + 2H^{+} + SO^{2-}_{4} = 2K^{+} + SO^{2-}_{4} + CO_{2} + H_{2}O$
$CO^{2-}_{3} + 2H^{+} = CO_{2} + H_{2}O$
Разобрали установку и привели в порядок рабочее место.
Пожалуйста, оцените решение