
Рассмотрите схемы образования ионной связи между атомами химических элементов: а) калия и кислорода; б) лития и хлора; в) магния и фтора.

Калий (К) и кислород (O).
Калий — это элемент главной подгруппы I группы Периодической системы Д.И. Менделеева, металл. Его атому легче отдать один внешний электрон, чем принять недостающие семь.
Кислород — элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, чем отдать 6 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2 * 1). Затем определим, сколько атомов калия нужно взять,чтобы они отдали два электрона (т.е. надо взять 2 атома калия), и сколько атомов кислорода надо взять, чтобы они могли принять два электрона (т.е. нужно взять 1 атом кислорода).
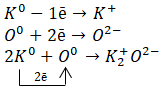
Литий (Li) и хлор (Cl).
Литий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7.
Хлор — элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, чем отдать 7 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 1 (1 * 1). Затем определим, сколько атомов лития нужно взять,чтобы они отдали один электрон (т.е. надо взять 1 атом лития), и сколько атомов хлора надо взять, чтобы они могли принять один электрон (т.е. нужно взять 1 атом хлора).
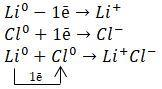
Магний (Mg) и фтор (F).
Магний — элемент II группы главной подгруппы, металл. Его атому легче отдать 2 внешних электрона, чем принять недостающие 6.
Фтор — элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, чем отдать 7 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2 * 1). Затем определим, сколько атомов магния нужно взять,чтобы они отдали два электрона (т.е. надо взять 1 атом магния), и сколько атомов фтора надо взять, чтобы они могли принять два электрон (т.е. нужно взять 2 атом фтора).
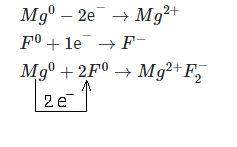
Пожалуйста, оцените решение