
Налейте в пробирку 1 − 2 мл концентрированного раствора серной кислоты и опустите в неё гранулу цинка. Составьте уравнение реакции в молекулярном и ионном видах, покажите переход электронов. Что в этой реакции является окислителем?

Серная кислота реагирует с цинком с образованием газа водорода, цинк при этом растворяется.
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}↑$
$Zn + 2H^{+} + SO_{4}^{2-} = Zn^{2+} + SO_{4}^{2-} + H_{2}↑ $
$Zn + 2H^{+} = Zn^{2+} + H_{2}↑$
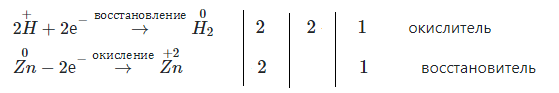
Пожалуйста, оцените решение