
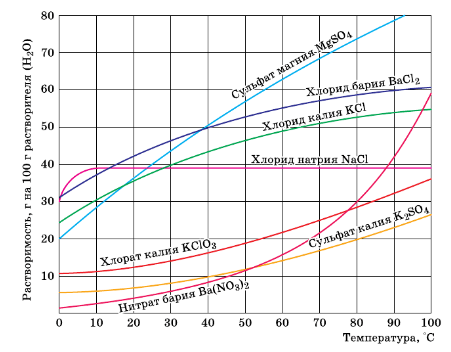
К 500 г насыщенного при 20 °C раствора сульфата магния (см. рис. 124) прилили достаточный для проведения реакции объём раствора хлорида бария. Найдите массу выпавшего осадка.
Рис. 124. Растворимость веществ в зависимости от температуры.

Дано:
$m_{1} (H_{2}O)$ = 100 г;
$m_{2} (р-ра)$ = 500 г;
t = 20 °C;
Найти:
$ω (BaSO_{4})$ − ?
Решение:
$MgSO_{4} + BaCl_{2} = MgCl_{2} + BaSO_{4}↓$;
Согласно рисунку при температуре 20°C в 100 г воды содержится 37 г $MgSO_{4}$.
$m_{1}(р-ра) = m_{1} (H_{2}O) + m_{1}(MgSO_{4}) = 100 + 37 = 137$ г;
$ ω (вещ-во) =\frac{m (в-во)}{m (р-р)}$;
$ω (MgSO_{4}) =\frac{m_{1}(MgSO_{4})}{m_{1} (р-ра)} = \frac {37}{137} = 0,27$ или 27%;
m (вещ−во) = m (р−ра) * ω;
$m_{2}(MgSO_{4}) = m_{2} (р-ра) * ω = 500 * 0,27 = 135$ г;
$n = \frac{m}{M}$;
M ($MgSO_{4}$) = 1 * Ar (Mg) + 1 * Ar (S) + 4 * Ar (O) = 1 * 24 + 1 * 32 + 4 * 16 = 120 г/моль;
$n (MgSO_{4}) = \frac{m_{2}(MgSO_{4})}{M (MgSO_{4})} = \frac {135}{120} = 1,125$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{1,125 моль}{MgSO_{4}}} + BaCl_{2} = MgCl_{2} + \underset{1 моль}{\overset{x}{BaSO_{4}↓}}$;
$x = n (BaSO_{4}) = \frac{1,125 * 1}{1} = 1,125$ моль;
m = n * M;
M ($BaSO_{4}$)= 1 * Ar (Ba) + 1 * Ar (S) + 4 * Ar (O) = 1 * 137 + 1 * 32 + 4 * 16 = 233 г/моль;
$m (BaSO_{4}) = n (BaSO_{4}) * M (BaSO_{4}) = 1,125 * 233 = 262$ г.
Ответ. 262 г.
Пожалуйста, оцените решение