
Определите тип химической связи и запишите схему её образования для веществ с формулами:
а) $S_{2}, K_{2}O$ и $H_{2}S$;
б) $N_{2}, LiF$ и $Cl_{3}N$.

$S_{2}$ − ковалентная неполярная связь, так как она образована атомами одного и того же элемента.
Сера (S) — это элемент главной подгруппы VI группы, неметалл. Его атомы имеют по шесть электронов на внешнем уровне.
Чтобы определить число неспаренных электронов, воспользуемся формулой:
8 – N = число неспаренных электронов, где N— номер группы химического элемента.
Следовательно, атомы серы будут иметь (8 – 6 = 2) два неспаренный электрона.
В молекуле $S_{2}$ атомы связаны двумя общими электронными парами, поэтому связь двойная.
Схема образования химической связи в молекуле $S_{2}$:

S = S
$K_{2}O$ − ионная связь, так как она образована атомами элементов металла и неметалла.
Калий — это элемент главной подгруппы I группы Периодической системы Д.И. Менделеева, металл. Его атому легче отдать один внешний электрон, чем принять недостающие семь.
Кислород — элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, чем отдать 6 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2 * 1). Затем определим, сколько атомов калия нужно взять,чтобы они отдали два электрона (т.е. надо взять 2 атома калия), и сколько атомов кислорода надо взять, чтобы они могли принять два электрона (т.е. нужно взять 1 атом кислорода).
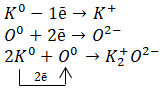
$H_{2}S$ − ковалентная полярная связь, так как она образована атомами разных элементов − неметаллов.
Водород (H) — это элемент главной подгруппы VII группы, неметалл. Его атомы имеют по семь электронов на внешнем уровне.
Непарных электронов будет: 8−7 = 1.
Сера (S) — это элемент главной подгруппы VI группы, неметалл. Его атомы имеют по шесть электронов на внешнем уровне.
Непарных электронов будет: 8−6 = 2.
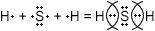
Н − S − H
Общие электронные пары будут смещены от водорода к сере, как к более электроорицательному элементу.

$N_{2}$ − ковалентная неполярная связь, так как она образована атомами одного и того же элемента.
Азот (N) — это элемент главной подгруппы V группы, неметалл. Его атомы имеют по пять электронов на внешнем уровне.
Непарных электронов будет: 8−5 = 3.
В молекуле $N_{2}$ атомы связаны тремя общими электронными парами, поэтому связь тройная.
Схема образования химической связи в молекуле $N_{2}$:


$LiF$ − ионная связь.
Литий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7.
Фтор — элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, чем отдать 7 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 1 (1 * 1). Затем определим, сколько атомов лития нужно взять,чтобы они отдали один электрон (т.е. надо взять 1 атом лития), и сколько атомов фтора надо взять, чтобы они могли принять один электрон (т.е. нужно взять 1 атом фтора).

$Cl_{3}N$ − ковалентная полярная связь.
Хлор (Cl) — это элемент главной подгруппы VII группы, неметалл. Его атомы имеют по семь электронов на внешнем уровне.
Непарных электронов будет: 8−7 = 1.
Азот (N) — это элемент главной подгруппы V группы, неметалл. Его атомы имеют по пять электронов на внешнем уровне.
Непарных электронов будет: 8−5 = 3.
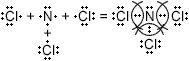

Общие электронные пары будут смещены от азота к хлору, как к более электроорицательному элементу.
Пожалуйста, оцените решение