
Приготовление раствора с заданной массовой долей растворенного вещества
Реактив: растворимая в воде соль.
Оборудование: весы, разновесы, плоскодонная колба на 50 мл, стеклянная палочка, шпатель, мерный цилиндр.
1) Расчёты
Рассчитайте массу соли и объём воды, которые необходимо взять для приготовления раствора.
2) Взвешивание
Для взвешивания веществ используют технохимические весы (рис. 128).
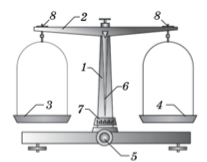
Рис. 128. Технохимические весы.
Порцию вещества, масса которой определена взвешиванием, называют навеской.
Технохимические весы состоят из стойки 1, коромысла 2, двух чашек 3, 4, предназначенных для вещества и разновесов. Весы имеют специальное приспособление (арретир), которое поддерживает чашки весов, когда они находятся в нерабочем (арретированном) положении. Чтобы привести весы в рабочее положение, поворачивают рукоятку 5, которая опускает арретир.
Перед началом работы необходимо проверить, уравновешены ли чашки весов. Для этого опускают арретир и смотрят, находится ли стрелка 6 строго посередине шкалы 7. Если она смещена, то для достижения равновесия вращают один из винтов 8, расположенных на концах коромысла.
Снимать и класть разновесы можно только тогда, когда весы находятся в нерабочем положении. Положив гирьки, опускают арретир. Если равновесия нет, вновь приводят весы в нерабочее положение, кладут еще один разновес, и так до тех пор, пока равновесие не будет достигнуто.
На левую чашку весов положите небольшой лист бумаги с загнутыми краями и уравновесьте его разновесами, помещая их пинцетом на правую чашку. Затем на правую чашку весов поместите гирьки, общая масса которых соответствует массе навески. На бумагу, находящуюся на левой чашке весов, насыпайте соль до тех пор, пока не будет достигнуто равновесие.
Поместите навеску соли в колбу.
3) Приготовление раствора
Необходимое количество воды, как и других жидкостей, удобно не взвешивать, а отмерять мерной посудой. Так как плотность воды при комнатной температуре близка к 1 г/мл, 1 г воды занимает обьём 1 мл. Отмерьте мерным цилиндром необходимый объём воды и перенесите его в колбу. Перемешивайте жидкость в колбе стеклянной палочкой до тех пор, пока все вещество не растворится. На листе бумаги напишите формулу и название соли, укажите ее массовую долю в растворе, массу навески соли и массу воды.

Приготовление раствора с заданной массовой долей растворенного вещества
1) Рассчитаем массу соли и объем воды, которые необходимо взять для приготовления раствора:
Дано:
$m_{р-ра}$ = 100 г
ω = 8%
ρ = 1 г/мл
Найти:
$m_{в-ва}$ − ?
V ($H_{2}O$) − ?
Решение:
$m_{в-ва}$ = $m_{р-ра}$ * ω = 100 г * 0,08 = 8 г
m ($H_{2}O$) = $m_{р-ра}$ − $m_{в-ва}$ = 100 г − 8 г = 92 г
V ($H_{2}O$) = $\frac{m}{ρ}$ = $\frac{92}{1}$ = 92 мл
Ответ: $m_{в-ва}$ = 8 г; V ($H_{2}O$) = 92 мл.
2) Для взвешивания веществ используют технохимические весы.
На левую чашку весов положили небольшой лист бумаги с загнутыми краями и уравновесили его разновесами, помещая их пинцетом на правую чашку. Затем на правую чашку весов поместили гирьки, общая масса которых соответствует массе навески. На бумагу, находящуюся на левой чашке весов, насыпали соль до тех пор, пока не будет достигнуто равновесие.
Поместили навеску соли в колбу.
3) Необходимое количество воды, как и других жидкостей, удобно не взвешивать, а отмерять мерной посудой. Так как плотность воды при комнатной температуре близка к 1 г/мл, 1 г воды занимает обьём 1 мл. Отмерили мерным цилиндром необходимый объём воды и перенесли его в колбу. Перемешивали жидкость в колбе стеклянной палочкой до тех пор, пока все вещество не растворилось. На листе бумаги написали формулу и название соли, указали ее массовую долю в растворе, массу навески соли и массу воды.
Пожалуйста, оцените решение