
Запишите уравнения реакций для следующих превращений:
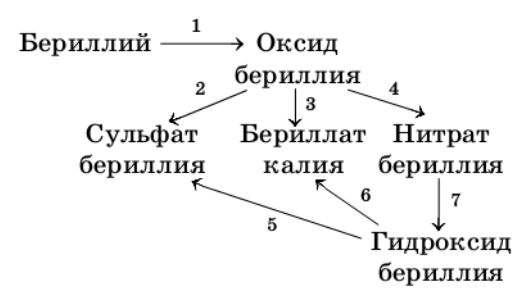
Первую реакцию рассмотрите с позиций окисления−восстановления.

1) $2Be + O_{2} = 2BeO$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$Be^{0} - 2ē ⟶ Be^{+2}$ − восстановитель
2) $BeO + H_{2}SO_{4} = BeSO_{4} + H_{2}O$
3) $BeO + K_{2}O = K2BeO2$
4) $BeO + 2HNO_{3} = Be(NO_{3})_{2} + H_{2}O$
5) $Be(OH)_{2} + H_{2}SO_{4} = BeSO_{4} + H_{2}O$
6) $Be(OH)_{2} + 2KOH = K_{2}BeO_{2} + 2H_{2}O$
7) $Be(NO_{3})_{2} + 2NaOH = 2NaNO_{3} + Be(OH)_{2}↓$
Пожалуйста, оцените решение