
Используя график зависимости растворимости веществ от температуры (рис. 1), определите массу кристаллов нитрата свинца $Pb(NO_{3})_{2}$, которые образуются при охлаждении 200 г насыщенного раствора этой соли от t = 80℃ до t = 40℃.
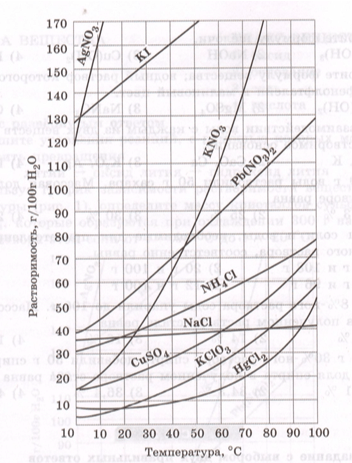
Рис. 1. Зависимость растворимости веществ от температуры

Дано:
m (р−ра) = 200 г
t = 80℃
$t_{1}$ = 40℃
S (растворимость) = 110 г/ 100 г $H_{2}O$
$S_{1}$ (растворимость) = 70 г/ 100 г $H_{2}O$
Найти:
m (кристаллов) − ?
Решение:
ω = $\frac{m (в-ва)}{m (р-ра}$ * 100% = $\frac{110}{110 + 100}$ = 52,4%
m ($Pb(NO_{3})_{2}$) = m (р−ра) * ω = 200 * 0,524 = 104,8 г
$ω_{1}$ = $\frac{m (в-ва)}{m (р-ра}$ * 100% = $\frac{70}{70 + 100}$ = 41,2%
$m_{1}$ ($Pb(NO_{3})_{2}$) = m (р−ра) * ω = 200 * 0,412 = 82,4 г
m (кристаллов) = m ($Pb(NO_{3})_{2}$) − $m_{1}$ ($Pb(NO_{3})_{2}$) = 104,8 − 82,4 = 22,4 г
Ответ: m (кристаллов) = 22,4 г.
Пожалуйста, оцените решение