
Основные положения ТЭД.
1) По способности проводить электрический ток в растворах

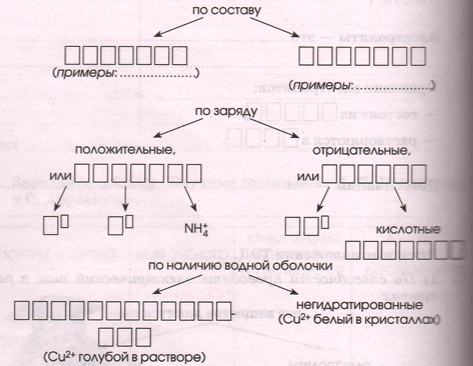
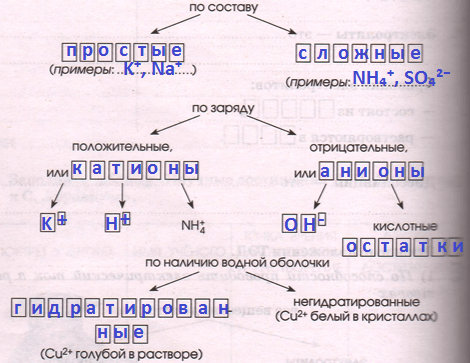
2) В растворах электролиты _ _ _ _ _ _ _ _ _ _ _ _ на _ _ _ _, т.е. _ _ _ _ _ _ _ _ _ _ _ _. Ионы различают:
Механизмы диссоциации электролитов с разным типом химической связи
| Электролиты с ионной связью (щелочи, соли) | Электролиты с ковалентной полярной связью (кислоты) |
|---|---|
| Ориентация молекул воды вокруг противоположно заряженнных ионов электролита | Ориентация _ |
| Гидратация − _ | Гидратация − _ |
| Ионизация − превращение ковалентной полярной связи в ионную | |
| Диссоциация − _ | Диссоциация − _ |
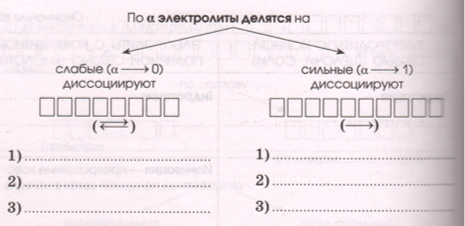
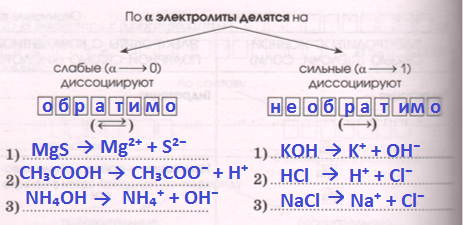
3) Разные электролиты по−разному диссоциируют на ионы, что характеризует степень электрической диссоциации − _ :

α зависит:
− от природы электролита, например: _
− от разбавления (как?) _
4) Как электролиты, все вещества делятся на три класса.
а) Кислоты − это электролиты, которые диссоциируют на _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ и _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _.
Например: $HNO_{3}$ = _ _ + _ _ _ _ ; $H_{2}SO_{4}$ = _ _ _ + _ _ _ _ _
б) Основания − _
Например: KOH = _ _ + _ _ _ ;
$Ba(OH)_ {2}$ = _ _ _ _ + _ _ _ _ .
в) Соли − _
Например: $Fe(NO_{3})_ {3}$ = _ _ _ _ + _ _ _ _ _ ;
$AlCl_{3}$ = _ _ _ _ + _ _ _ _.

Основные положения ТЭД.
1) По способности проводить электрический ток в растворах

2) В растворах электролиты распадаются на ионы, т.е. диссоциируют. Ионы различают:
Механизмы диссоциации электролитов с разным типом химической связи
| Электролиты с ионной связью (щелочи, соли) | Электролиты с ковалентной полярной связью (кислоты) |
|---|---|
| Ориентация молекул воды вокруг противоположно заряженнных ионов электролита | Ориентация молекул воды вокруг электроотрицательного и электроположительного концов молекулы электролита. |
| Гидратация − взаимодействие молекул воды с противоположно заряженными ионами поверхностного слоя элекролита. | Гидратация − взаимодействие молекул воды с молекулами элекролита. |
| Ионизация − превращение ковалентной полярной связи в ионную | |
| Диссоциация − распад на катионы металла или аммония и на гидроксид−анионы или анионы кислотного остатка. | Диссоциация − распад на катионы водорода и анионы кислотного остатка |
3) Разные электролиты по−разному диссоциируют на ионы, что характеризует степень электрической диссоциации − _ :

α зависит:
− от природы электролита, например: нерастворимые основания практически не диссоциируют
− от разбавления (как?): степень диссоциации растет по мере разбавления раствора
4) Как электролиты, все вещества делятся на три класса.
а) Кислоты − это электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка.
Например: $HNO_{3}$ = $H^{+} + NO_{3}^{-}$; $H_{2}SO_{4}$ = $H^{+} + SO_{4}^{2-}$
б) Основания − это электролиты, которые диссоциируют на катионы металла и гидроксид−анионы.
Например: KOH = $K^{+} + OH^{-}$;
$Ba(OH)_ {2}$ = $Ba^{2+} + 2OH^{-}$.
в) Соли − это электролиты, которые диссоциируют на катионы металла и анионы кислотного остатка.
Например: $Fe(NO_{3})_{3}$ = $Fe^{3+} + 3NO_{3}^{-}$;
$AlCl_{3}$ = $Al^{3+} + 3Cl^{-}$.
Пожалуйста, оцените решение